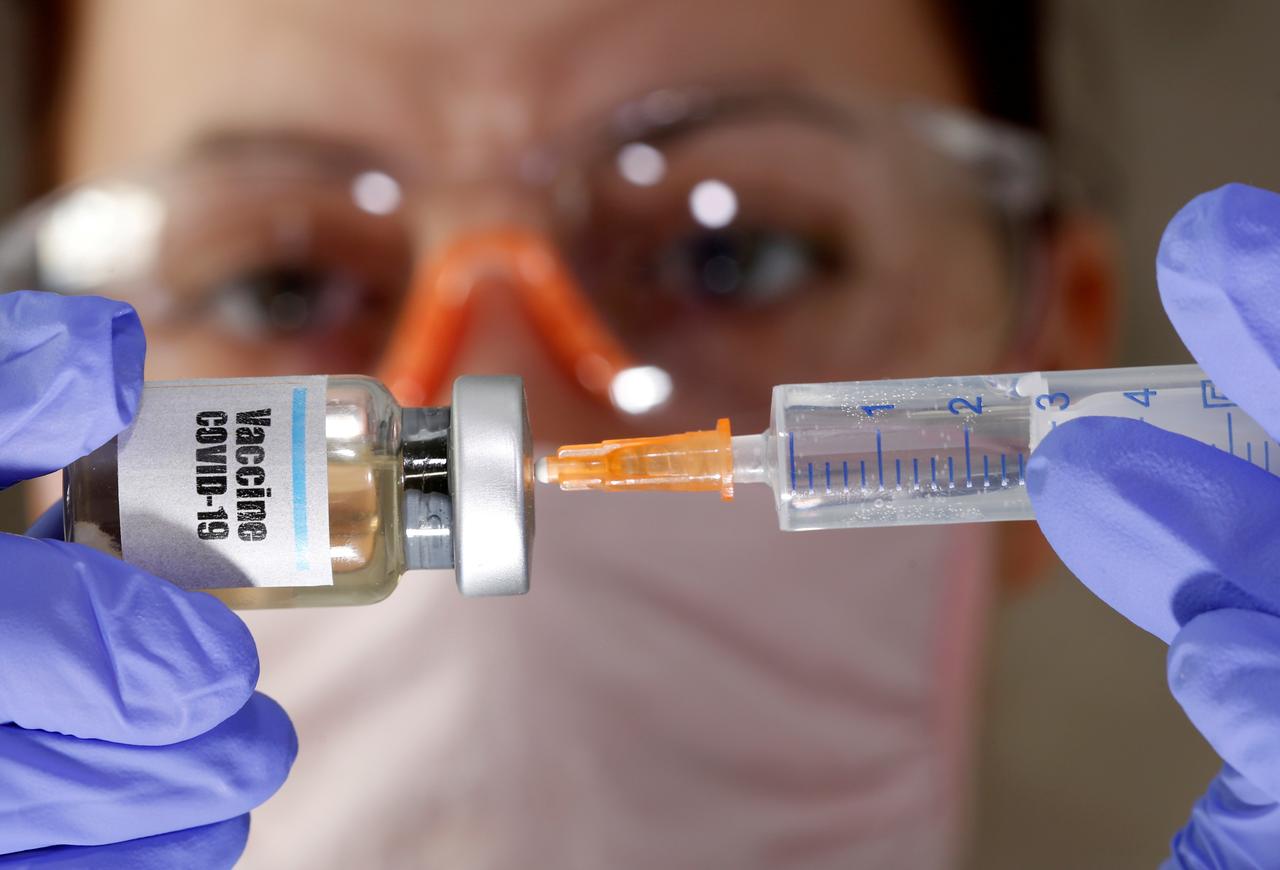
अंतरराष्ट्रीय दवा निर्माता कंपनी फाइज़र के बाद सीरम इंस्टिट्यूट ऑफ इंडिया और भारत बायोटेक ने देश में कोरोना वायरस से संबंधित टीके के इस्तेमाल की मंज़ूरी मांगी थी. केंद्रीय औषधि मानक नियंत्रण संगठन के विशेषज्ञों की एक समिति ने इन कंपनियों से संभावित टीके के परीक्षण से संबंधित और अधिक जानकारी मांगी है.

नई दिल्ली: केंद्रीय औषधि मानक नियंत्रण संगठन (सीडीएससीओ) के विशेषज्ञों की एक समिति ने बीते बुधवार को कोविड-19 टीका के लिए सीरम इंस्टिट्यूट ऑफ इंडिया और भारत बायोटेक से अतिरिक्त सुरक्षा एवं प्रभावी डाटा मांगा है. टीके के आपातकालीन उपयोग के लिए अनुमति मांगने के उनके आवेदन पर विचार-विमर्श के बाद उन्होंने यह डाटा मांगा है.
इसके अलावा अमेरिकी दवा कंपनी फाइजर की भारतीय शाखा के आवेदन पर बुधवार को विचार-विमर्श नहीं हुआ, क्योंकि कंपनी ने समिति के समक्ष प्रस्तुतीकरण देने के लिए और समय मांगा.
एक सूत्र ने बताया कि भारत बायोटेक और सीरम इंस्टिट्यूट ऑफ इंडिया के आवेदन अब भी विचाराधीन हैं.
सूत्रों ने बताया कि सीरम इंस्टिट्यूट के आवेदन पर विचार करते हुए सीडीएससीओ की विषय विशेषज्ञ समिति (एसईसी) ने देश में दूसरे चरण और तीसरे चरण के परीक्षण पर अद्यतन सुरक्षा डाटा, ब्रिटेन और भारत में क्लीनिकल परीक्षण के प्रतिरक्षाजनक डाटा की मांग की है. साथ ही ब्रिटेन औषधि एवं स्वास्थ्य देखभाल उत्पाद नियामक एजेंसी (एमएचआरए) के आकलन का परिणाम भी मांगा है.
Minutes of the SEC, CDSCO meeting on Covid vaccines:
SII has been asked to submit updated safety data, immunogenicity data and outcome of assessment of UK-MHRA for grant of Emergency Use Authorisation.
Bharat Biotech has been asked to submit safety and efficacy data. pic.twitter.com/bWiA3Jj1da
— Arvind Gunasekar (@arvindgunasekar) December 9, 2020
हैदराबाद के भारत बायोटेक के लिए विस्तृत विचार-विमर्श के बाद एसईसी ने अनुशंसा की कि कंपनी को देश में वर्तमान में जारी तीसरे चरण के क्लीनिकल परीक्षण की सुरक्षा एवं प्रभाविता संबंधी डाटा पेश करना चाहिए, ताकि इस पर आगे विचार किया जा सके.
एक आधिकारिक सूत्र ने बताया, ‘सीडीएससीओ के कोविड-19 पर एसईसी ने दोनों आवेदनों पर करीब चार घंटे तक विचार-विमर्श किया. एसईसी की अनुशंसाओं को भारत के औषधि महानियंत्रक ने मंजूरी दे दी है.’
एसईसी बैठक के मिनट्स के अनुसार, एसआईआई को इसके ऑक्सफोर्ड-एस्ट्राजेनेका द्वारा विकसित कोविशील्ड वैक्सीन के लिए विशेष रूप से सुरक्षा डेटा जमा करने के लिए कहा गया है. इसके अलावा यूके (ब्रिटेन) और भारत में क्लीनिकल ट्रायल से प्रतिरक्षाजनकता (इम्यूनोजेनेसिटी) डेटा, साथ ही इसके आपातकालीन उपयोग आवेदन के संबंध में यूके नियामक प्राधिकरण के मूल्यांकन के परिणाम साझा करने को कहा गया है.
विशेषज्ञ समिति ने उल्लेख किया कि एसआईआई ने केवल ‘14 नवंबर तक का सुरक्षा डेटा प्रस्तुत किया है’ और इसके अध्ययन के प्रमुख इन्वेस्टिगेटर डॉ. सुशांत मेश्राम, जो ट्रायल्स में शामिल हैं, बैठक में शामिल नहीं हुए.
भारत बायोटेक, जो वर्तमान में अपने स्वदेशी वैक्सीन कोवैक्सीन के तीसरे चरण का ट्रायल कर रहा है, ने केवल अपने फेज-1 और 2 के परीक्षणों के अंतरिम सुरक्षा और इम्युनोजेनेसिटी डेटा प्रस्तुत किए हैं. बुधवार को इसकी प्रस्तुति के बाद एसईसी ने इसे फेज-3 ट्रायल से सुरक्षा और प्रभावकारिता डेटा प्रस्तुत करने को कहा है.
भारत बायोटेक और भारतीय औषधि अनुसंधान परिषद् (आईसीएमआर) मिलकर स्वदेशी टीका कोवैक्सीन का विकास कर रहे हैं.
भारत बायोटेक ने कोवैक्सिन के आपातकालीन इस्तेमाल की मंजूरी देने के लिए भारत के औषधि महानियंत्रक (डीसीजीआई) के पास सात दिसंबर को आवेदन दिया था. वहीं पुणे के सीरम इंस्टिट्यूट ने ऑक्सफोर्ड कोविड-19 टीका कोविशील्ड के लिए छह दिसंबर को मंजूरी मांगी थी.
फाइजर ने अपने टीके के आपातकालीन इस्तेमाल की मंजूरी के लिए चार दिसंबर को आवेदन दिया था.
(समाचार एजेंसी भाषा से इनपुट के साथ)